کربوکسیلات ها
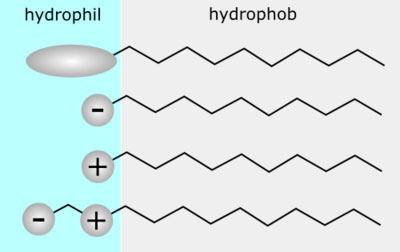
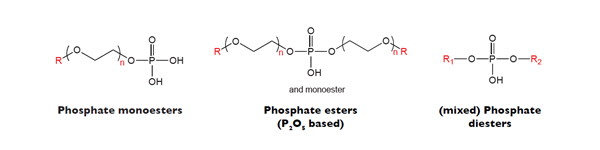
کربوکسیلات ها دسته ای از سورفکتانت های آنیونی هستند که در آن گروه کربوکسیل وجود دارد. صابون ها دسته ای از کربوکسیلات ها می باشند. اتوکسی کربوکسیلات ها، استرکربوکسیلات ها، از دیگر انواع کربوکسیلات ها می باشند.
کربوکسیلات ها دسته ای از سورفکتانت های آنیونی هستند که در آن گروه کربوکسیل وجود دارد. صابون ها دسته ای از کربوکسیلات ها می باشند. اتوکسی کربوکسیلات ها، استرکربوکسیلات ها، از دیگر انواع کربوکسیلات ها می باشند.
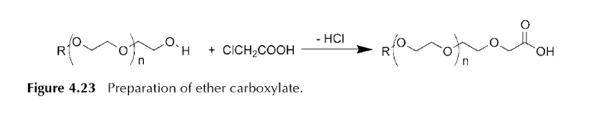
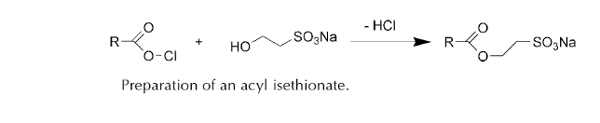
استر کربوکسیلات ها
از واکنش یک الکل چرب با زنجیر بلند با یک اسید چندتایی، استر کربوکسیلات ها به وجود می آیند.
از واکنش یک الکل چرب با زنجیر بلند با یک اسید چندتایی، استر کربوکسیلات ها به وجود می آیند.
صابون ها
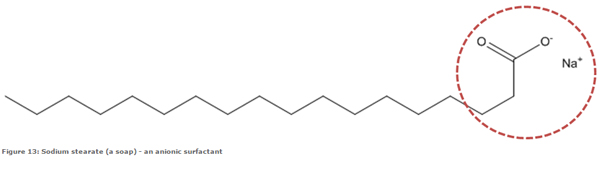
صابون یک سورفکتانت آنیونی از جنس کربوکسیلات است که اسید چرب تشکیل دهنده آن می تواند دودسیل، میریستیل، استئاریک یا اولئیک باشد. مزیت صابون ها آن است که حاوی مواد نفتی نیستند اما عیب بزرگ صابون ها ناپایداری در برابر یون کلسیم و منیزیم (سختی آب) است. صابون پیه، صابون نارگیل، صابون های اولئیک و صابون های تال از انواع مختلف صابون می باشند. بیشتر بدانیم
صابون یک سورفکتانت آنیونی از جنس کربوکسیلات است که اسید چرب تشکیل دهنده آن می تواند دودسیل، میریستیل، استئاریک یا اولئیک باشد. مزیت صابون ها آن است که حاوی مواد نفتی نیستند اما عیب بزرگ صابون ها ناپایداری در برابر یون کلسیم و منیزیم (سختی آب) است. صابون پیه، صابون نارگیل، صابون های اولئیک و صابون های تال از انواع مختلف صابون می باشند. بیشتر بدانیم
دسته بندی شوینده ها
شوینده ها یا سورفکتانت ها را به روش های مختلفی دسته بندی می کنند. بر اساس ساختار شیمیایی، سورفکتانت ها به چهار دسته آنیونی، غیریونی، کاتیونی و آمفوتری طبقه بندی می شوند.
شوینده ها یا سورفکتانت ها را به روش های مختلفی دسته بندی می کنند. بر اساس ساختار شیمیایی، سورفکتانت ها به چهار دسته آنیونی، غیریونی، کاتیونی و آمفوتری طبقه بندی می شوند.
کف کنندگی شوینده ها
کف از حباب های گاز با دیوارهای نازک از مایع ساخته شده که ساختاری سه بعدی دارد. مایع از دیواره ها به وسیله نیروی گرانش به محل اتصال کشیده می شود. شوینده ها با اثر بر خواص الکترواستاتیکی، ویسکوزیته سطح، ویسکوزیته کل و الاستیسیته فیلم می توانند موجب افزایش میزان کف شوند. روابط بین کف کنندگی و ساختار شیمیایی یک ماده شوینده در این مبحث توضیح داده شده است. بیشتر بدانیم
کف از حباب های گاز با دیوارهای نازک از مایع ساخته شده که ساختاری سه بعدی دارد. مایع از دیواره ها به وسیله نیروی گرانش به محل اتصال کشیده می شود. شوینده ها با اثر بر خواص الکترواستاتیکی، ویسکوزیته سطح، ویسکوزیته کل و الاستیسیته فیلم می توانند موجب افزایش میزان کف شوند. روابط بین کف کنندگی و ساختار شیمیایی یک ماده شوینده در این مبحث توضیح داده شده است. بیشتر بدانیم
امولسیون کنندگی شوینده ها
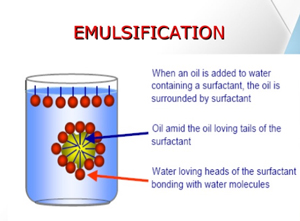
وقتی یک ماده نامحلول مثل روغن به آب حاوی شوینده اضافه می شود، احتمال تشکیل امولسیون وجود دارد. این امولسیون می تواند روغن در آب یا آب در روغن باشد. دو حالت دیگر هم ممکن است به وجود آید که یکی انحلال روغن در آب و یا تشکیل میکروامولسیون ها است. پارامتر HLB ارتباط منطقی بین ساختار شوینده و امولسیون کنندگی آن را نشان می دهد. بیشتر بدانیم
وقتی یک ماده نامحلول مثل روغن به آب حاوی شوینده اضافه می شود، احتمال تشکیل امولسیون وجود دارد. این امولسیون می تواند روغن در آب یا آب در روغن باشد. دو حالت دیگر هم ممکن است به وجود آید که یکی انحلال روغن در آب و یا تشکیل میکروامولسیون ها است. پارامتر HLB ارتباط منطقی بین ساختار شوینده و امولسیون کنندگی آن را نشان می دهد. بیشتر بدانیم
میسل چیست؟
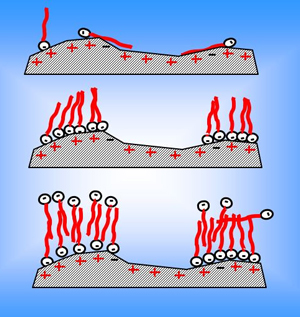
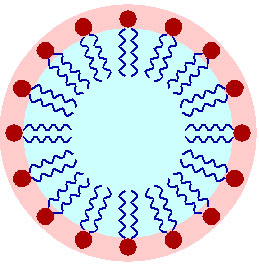
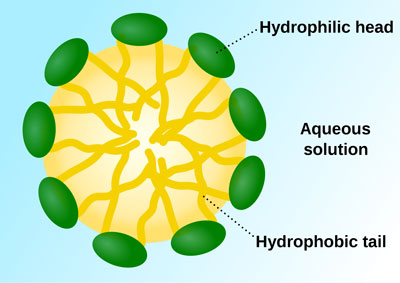
میسل ها توده های کروی هستند که قسمت درونی آن ها هیدروکربنی است. غلظتی از شوینده که در آن اولین میسل ها تشکیل می شوند، غلظت بحرانی میسل نام دارد. اندازه میسل با کمیتی به نام عدد تجمع اندازه گیری می شود.
میسل ها توده های کروی هستند که قسمت درونی آن ها هیدروکربنی است. غلظتی از شوینده که در آن اولین میسل ها تشکیل می شوند، غلظت بحرانی میسل نام دارد. اندازه میسل با کمیتی به نام عدد تجمع اندازه گیری می شود.
حلالیت شوینده ها
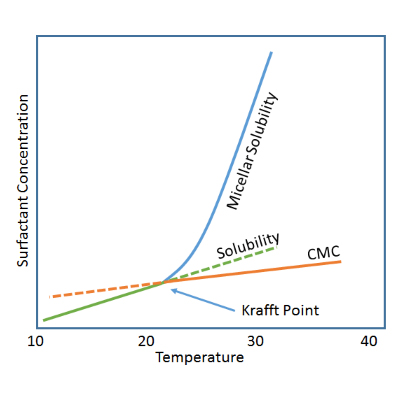
معمولاً حلالیت مولکول های شوینده در آب با افزایش دما افزایش می یابد و معمولاً در دمای خاصی میزان حلالیت به شکل چشمگیری افزایش می یابد که به آن دما نقطه کرافت می گویند. توجه داشته باشیم که برخی شوینده ها از این قانون تبعیت نمی کنند. یعنی با افزایش دما، حلالیتشان کاهش می یابد. کاهش نقطه کرافت باعث افزایش تولید میسل می شود. بیشتر بدانیم
معمولاً حلالیت مولکول های شوینده در آب با افزایش دما افزایش می یابد و معمولاً در دمای خاصی میزان حلالیت به شکل چشمگیری افزایش می یابد که به آن دما نقطه کرافت می گویند. توجه داشته باشیم که برخی شوینده ها از این قانون تبعیت نمی کنند. یعنی با افزایش دما، حلالیتشان کاهش می یابد. کاهش نقطه کرافت باعث افزایش تولید میسل می شود. بیشتر بدانیم
تئوری شوینده ها
اگرچه مواد شوینده معمولاً با روش های آزمون و خطا فرمول بندی می شوند و با استفاده از تئوری نمی توان بسیاری از مشکلات را حل کرد، اما با این حال برای درک بهتر عملکرد شوینده ها، دانستن تئوری شوینده ها کمک زیادی می کند. پدیده جذب، کشش سطحی، پدیده میسل، خیس کنندگی شوینده، پراکنده سازی، کف کنندگی و امولسیون کنندگی شوینده ها از خواصی هستند که رفتار یک شوینده را توجیه می کنند. بیشتر بدانیم
اگرچه مواد شوینده معمولاً با روش های آزمون و خطا فرمول بندی می شوند و با استفاده از تئوری نمی توان بسیاری از مشکلات را حل کرد، اما با این حال برای درک بهتر عملکرد شوینده ها، دانستن تئوری شوینده ها کمک زیادی می کند. پدیده جذب، کشش سطحی، پدیده میسل، خیس کنندگی شوینده، پراکنده سازی، کف کنندگی و امولسیون کنندگی شوینده ها از خواصی هستند که رفتار یک شوینده را توجیه می کنند. بیشتر بدانیم
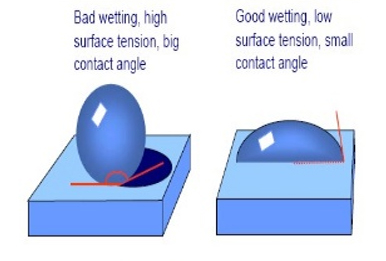
خیس کنندگی شوینده ها
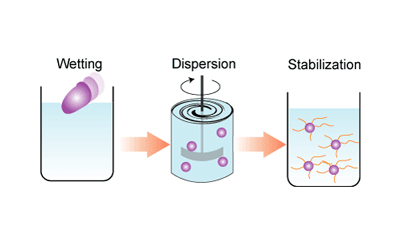
وقتی قطره آب روی سطحی قرار می گیرد دو حالت پیش می آید: یا روی آن سطح پخش می شود و یا این که شکل قطره محفوظ می ماند. اگر پخش شود، می گوییم سطح خیس شده و اگر شکل قطره محفوظ بماند، آن سطح خیس نشده است. کاهش کشش سطحی آب در اثر افزودن یک ماده شوینده یا سورفکتانت می تواند یک محلول غیرمرطوب کننده را به یک محلول مرطوب کننده تبدیل کند. بین ساختار شیمیایی و مرطوب کنندگی ارتباطاتی وجود دارد که در این قسمت توضیح داده شده است. یکی از عملکردهای ماده شوینده، سوسپانسیون کردن ذرات جامد در یک مایع مثل آب است. به این فرآیند disperse کردن می گویند. تئوری DLVO پایداری سوسپانسیون ها را توجیه می کند. بیشتر بدانیم
وقتی قطره آب روی سطحی قرار می گیرد دو حالت پیش می آید: یا روی آن سطح پخش می شود و یا این که شکل قطره محفوظ می ماند. اگر پخش شود، می گوییم سطح خیس شده و اگر شکل قطره محفوظ بماند، آن سطح خیس نشده است. کاهش کشش سطحی آب در اثر افزودن یک ماده شوینده یا سورفکتانت می تواند یک محلول غیرمرطوب کننده را به یک محلول مرطوب کننده تبدیل کند. بین ساختار شیمیایی و مرطوب کنندگی ارتباطاتی وجود دارد که در این قسمت توضیح داده شده است. یکی از عملکردهای ماده شوینده، سوسپانسیون کردن ذرات جامد در یک مایع مثل آب است. به این فرآیند disperse کردن می گویند. تئوری DLVO پایداری سوسپانسیون ها را توجیه می کند. بیشتر بدانیم
• undefined
•
مطلب فوق را در شبکه های اجتماعی زیر با دوستانتان به اشتراک بگذارید