سورفکتانت ها: پدیده جذب
نویسنده:
سید مسیح میرمقتدایی
کارشناس ارشد تحقیق و توسعه شرکت گلتاش
کارشناس ارشد تحقیق و توسعه شرکت گلتاش
massih113@yahoo.com
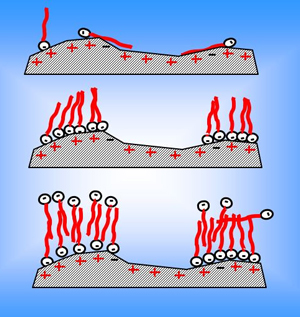
بسیاری از ترکیبات شیمیایی، کف و سطوح مرطوب ایجاد می کنند ولی جزء ترکیبات شوینده دسته بندی نمی شوند، مانند متیل الکل در محلول آبی. خصلت اصلی یک شوینده این است که تجمع آن در سطح مایع بیشتر از درون مایع است.
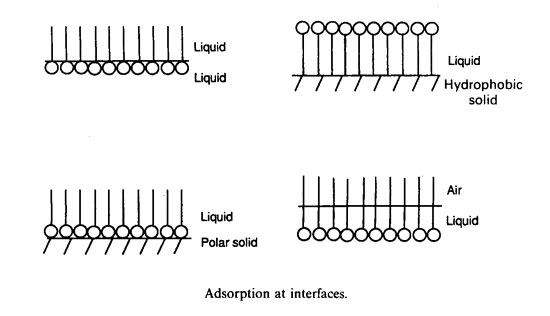
این پدیده جذب نام دارد و در سطوح مابین
مایع–جامد،
مایع–مایع
و هوا–مایع
ایجاد می شود که در شکل 1-1 نشان داده شده است.
شکل 1-1 : جذب در بین سطوح مختلف
در شکل 1-1 مولکول شوینده به صورت یک شاخه آب گریز بلند و یک سر کوچک آبدوست مشخص گردیده که در جهت های مختلفی می تواند قرار گیرد. در نظر گرفتن ساختار مولکول شوینده به شکل مذکور، در واقع یک نوع ساده سازی است که متناسب با شکل ها و اندازه های این نوع مولکول ها در نظر گرفته شده و بیانگر بسیاری از خواص آن ها می باشد.
بنابراین فعلاً از این اشکال ساده استفاده می کنیم. جذب مواد شوینده در سطح بین مایع-هوا تغییراتی فیزیکی در مایع ایجاد می کند که هرچه مقدار این مولکول ها (تا حد پوشیده شدن کامل سطح) افزایش یابد، میزان این تغییرات نیز زیادتر خواهد شد.
از اثر کشش سطحی برای مطالعه و اندازه گیری جذب استفاده می شود. مثالی از دو ماده شوینده در شکل 1-2 آورده شده که در نمودار مربوطه کشش سطحی بر اساس غلظت ترسیم شده است.
دو مورد قابل توجه در این شکل عبارتند از:
از آن جایی که جذب به معنای مقدار ماده در سطح مایع نسبت به مقدار آن در خود مایع است، به نظر می رسد اندازه گیری آن به راحتی صورت می گیرد. متأسفانه در حالت مایع–مایع و مایع–هوا این اندازه گیری بسیار مشکل بوده و باید به صورت غیرمستقیم مشخص گردد.
در مورد جذب ما بین فازهای مایع–جامد، غلظت ماده شوینده قبل و بعد از اضافه شدن به سطح مورد نظر قابل اندازه گیری بوده و از اینرو مقدار جذب شده قابل سنش است. تشخیص دقیق قسمت هایی از سطح جامد که رون مایع قرار دارد مشکل است. بنابراین تعیین مقدار ماده شوینده جذب شده بر واحد سطح به آسانی قابل اندازه گیری نخواهد بود. جذب دقیق و میزان سطح به ازاء مولکول جذب شده را می توان از طریق معادله هم دمای گیبس محاسبه کرد ولی این معادلات در غلظت های بیشتر از cmc (غلظت بحرانی میسل) صادق نیستند. این معادله تغییرات کشش سطحی رابه غلظت ماده شوینده مرتبط می سازد.
جذب شوینده ها در سطح با تغییر ساختار مولکول شوینده، تغییر می کند. گروه های آبدوست متمایل به انحلال در فاز آبی بوده در حالی که قسمت آبگیز آن تمایل کمتری برای انحلال در این فاز دارد. مولکول های آب با یکدیگر قدیت و تمایل زیادتری برای انحلال قسمت قطبی مولکول شوینده دارند. بنابراین کل مولکول توسط قسمت آبگریز شوینده، بستگی به خواص سطحی دارد که در تماس با آن می باشد. اگر این سطح هوا باشد، دم غیر قطبی به سمت خارج از آب جهت گیری پیدا می کنند (شکل 1-1)، اگر یک جامد آبگریز باشد به سمت جامد و اگر جامد بسیار قطبی باشد به سمت آب قرار خواهد گرفت.
جذب ماده شوینده بر روی سطوح جامد بستگی به نوع آن (قطبی یا غیرقطبی) دارد. مکانیسم جذب کاملاً مشخص نشده است ولی جهت مشخص کردن جزئیات پیچیده آن، می تان به خلاصه زیر از Myers(1988) اشاره کرد:
2- با شوینده های قطبی میزان جذب می تواند افزایش یابد؛ گروه قطبی به طرف سطح قرار گرفته و زنجیره آبگریز، قسمت آبگریز را ایجاد می کنند. یک لایه دوم نیز می تواند با گروه های آبدوست به سمت بیرون تشکیل شود.
2- میزان جذب شوینده های یونی با افزودن الکترولیت ها قابل افزایش است زیرا لایه های دوتایی الکتریکی را کاهش می دهند.
3- انواع غیریونی به مراتب بیش از انواع یونی جذب می شوند (دهها برابر).
4- افزودن الکترولیتها اثر قابل توجهی بر روی میزان جذب انواع غیریونی ندارد.
5- اثر دما: جذب انواع یونی با افزایش دما کاهش می یابد. جذب اتوکسیلات ها با افزایش دما افزایش می یابد 0زیرا آن ها با افزایش دما کمتر آبپوشی شده و در نتیه آبگریزتر می شوند).
6- افزایش طول زنجیره هیدروکربنی میزان جذب را افزایش می دهد.
7- شاخه دار شدن زنجیره هیدروکربنی میزان جذب را کاهش می دهد.
مولکولهای جذب شده ثابت نیستند بلکه با مولکول های مجاور خود در یک تعادل پویا قرار دارند. همچنین آنها نیازمند یک زمان مشخصی جهت جذب شدن بوده که این امر بستگی به شکل و اندازه ملکول شوینده و مکانیسم جذب دارد.
اکثر کاربردهای عملی شوینده ها مانند شویندگی، مرطوب کنندگی، کف کنندگی و ... یک فرآیند پویا بوده و سیستم به صورت تعادلی نمی باشد. اگر یک فیلم نازک از یک مایع حاوی شوینده را روی یک سطح پهن کنیم، یک سطح جدید ایجاد می گردد.
مولکول های ماده شوینده نمی توانند به سرعت سطح در حال تشکیل شدن حرکت کنند و بنابراین میزان جذب در واحد سطح کاهش می یابد (شکل 1-3). جذب شدن کمتر شوینده باعث افزایش کشش سطحی می شود. لذا نیرویی در زاویه های سمت راست، به سطح اعمال شده که به تجدید دوباره تعادل ذکر شده کمک ی کند. این حالت به الاستیسیتۀ فیلم گیبس و اثر مارانگونی معروف است و از آن برای توجیه پایداری کف استفاده می شود.

شکل 1-1 : جذب در بین سطوح مختلف
بنابراین فعلاً از این اشکال ساده استفاده می کنیم. جذب مواد شوینده در سطح بین مایع-هوا تغییراتی فیزیکی در مایع ایجاد می کند که هرچه مقدار این مولکول ها (تا حد پوشیده شدن کامل سطح) افزایش یابد، میزان این تغییرات نیز زیادتر خواهد شد.
از اثر کشش سطحی برای مطالعه و اندازه گیری جذب استفاده می شود. مثالی از دو ماده شوینده در شکل 1-2 آورده شده که در نمودار مربوطه کشش سطحی بر اساس غلظت ترسیم شده است.
شکل
1-2
کشش سطحی در مقابل غلظت
اول اینکه برای هر دو ماده، نمودار ناپیوسته بوده و با افزایش غلظت، کشش سطحی به سرعت کاهش می یابد تا جایی که در اثر بالا بردن غلظت، تغییرات کشش سطحی بسیار کم می شود. این نقطه ایی است که در آن، سطح با یک تک لایه از مولکول های شوینده پوشیده شده است.
دوم اینکه شوینده 1 همانند شوینده 2 عمل می کند ولی از نظر کمی با یکدیگر متفاوتند (شیب نمودارها و نقطه تشکیل تک لایه مولکول، متفاوت است). همچنین حداقل کشش سطحی ایجاد شده حاصل از اضافه کردن این دو ماده با یکدیگر متفاوت می باشد. این مغایرت ها به دلیل تفاوت در شکل و اندازه قسمت های آب دوست و آب گریز این مولکول ها بوده و این بدان معنا است که تراکم این دو نوع مولکول شوینده در سطح، متفاوت می باشد.
دوم اینکه شوینده 1 همانند شوینده 2 عمل می کند ولی از نظر کمی با یکدیگر متفاوتند (شیب نمودارها و نقطه تشکیل تک لایه مولکول، متفاوت است). همچنین حداقل کشش سطحی ایجاد شده حاصل از اضافه کردن این دو ماده با یکدیگر متفاوت می باشد. این مغایرت ها به دلیل تفاوت در شکل و اندازه قسمت های آب دوست و آب گریز این مولکول ها بوده و این بدان معنا است که تراکم این دو نوع مولکول شوینده در سطح، متفاوت می باشد.
از آن جایی که جذب به معنای مقدار ماده در سطح مایع نسبت به مقدار آن در خود مایع است، به نظر می رسد اندازه گیری آن به راحتی صورت می گیرد. متأسفانه در حالت مایع–مایع و مایع–هوا این اندازه گیری بسیار مشکل بوده و باید به صورت غیرمستقیم مشخص گردد.
در مورد جذب ما بین فازهای مایع–جامد، غلظت ماده شوینده قبل و بعد از اضافه شدن به سطح مورد نظر قابل اندازه گیری بوده و از اینرو مقدار جذب شده قابل سنش است. تشخیص دقیق قسمت هایی از سطح جامد که رون مایع قرار دارد مشکل است. بنابراین تعیین مقدار ماده شوینده جذب شده بر واحد سطح به آسانی قابل اندازه گیری نخواهد بود. جذب دقیق و میزان سطح به ازاء مولکول جذب شده را می توان از طریق معادله هم دمای گیبس محاسبه کرد ولی این معادلات در غلظت های بیشتر از cmc (غلظت بحرانی میسل) صادق نیستند. این معادله تغییرات کشش سطحی رابه غلظت ماده شوینده مرتبط می سازد.
جذب شوینده ها در سطح با تغییر ساختار مولکول شوینده، تغییر می کند. گروه های آبدوست متمایل به انحلال در فاز آبی بوده در حالی که قسمت آبگیز آن تمایل کمتری برای انحلال در این فاز دارد. مولکول های آب با یکدیگر قدیت و تمایل زیادتری برای انحلال قسمت قطبی مولکول شوینده دارند. بنابراین کل مولکول توسط قسمت آبگریز شوینده، بستگی به خواص سطحی دارد که در تماس با آن می باشد. اگر این سطح هوا باشد، دم غیر قطبی به سمت خارج از آب جهت گیری پیدا می کنند (شکل 1-1)، اگر یک جامد آبگریز باشد به سمت جامد و اگر جامد بسیار قطبی باشد به سمت آب قرار خواهد گرفت.
جذب ماده شوینده بر روی سطوح جامد بستگی به نوع آن (قطبی یا غیرقطبی) دارد. مکانیسم جذب کاملاً مشخص نشده است ولی جهت مشخص کردن جزئیات پیچیده آن، می تان به خلاصه زیر از Myers(1988) اشاره کرد:
شوینده های قطبی یا آبدوست:
1- ماهیت شیمیایی سطح می تواند نقش مهمی ایفاد کند. برای مثال اکسیدهای فلزی می توانند با شوینده های آنیونی در سطح تولید نمک کنند (جذب شیمیایی).2- با شوینده های قطبی میزان جذب می تواند افزایش یابد؛ گروه قطبی به طرف سطح قرار گرفته و زنجیره آبگریز، قسمت آبگریز را ایجاد می کنند. یک لایه دوم نیز می تواند با گروه های آبدوست به سمت بیرون تشکیل شود.
شوینده های غیرقطبی یا آب گریز:
1- میزان جذب با شوینده های یونی بی نهایت کم است؛ 104 mol/g بر روی کربن فعال در محلول 0.05 درصدی سدیم دودسیل سولفات.2- میزان جذب شوینده های یونی با افزودن الکترولیت ها قابل افزایش است زیرا لایه های دوتایی الکتریکی را کاهش می دهند.
3- انواع غیریونی به مراتب بیش از انواع یونی جذب می شوند (دهها برابر).
4- افزودن الکترولیتها اثر قابل توجهی بر روی میزان جذب انواع غیریونی ندارد.
5- اثر دما: جذب انواع یونی با افزایش دما کاهش می یابد. جذب اتوکسیلات ها با افزایش دما افزایش می یابد 0زیرا آن ها با افزایش دما کمتر آبپوشی شده و در نتیه آبگریزتر می شوند).
6- افزایش طول زنجیره هیدروکربنی میزان جذب را افزایش می دهد.
7- شاخه دار شدن زنجیره هیدروکربنی میزان جذب را کاهش می دهد.
مولکولهای جذب شده ثابت نیستند بلکه با مولکول های مجاور خود در یک تعادل پویا قرار دارند. همچنین آنها نیازمند یک زمان مشخصی جهت جذب شدن بوده که این امر بستگی به شکل و اندازه ملکول شوینده و مکانیسم جذب دارد.
اکثر کاربردهای عملی شوینده ها مانند شویندگی، مرطوب کنندگی، کف کنندگی و ... یک فرآیند پویا بوده و سیستم به صورت تعادلی نمی باشد. اگر یک فیلم نازک از یک مایع حاوی شوینده را روی یک سطح پهن کنیم، یک سطح جدید ایجاد می گردد.
مولکول های ماده شوینده نمی توانند به سرعت سطح در حال تشکیل شدن حرکت کنند و بنابراین میزان جذب در واحد سطح کاهش می یابد (شکل 1-3). جذب شدن کمتر شوینده باعث افزایش کشش سطحی می شود. لذا نیرویی در زاویه های سمت راست، به سطح اعمال شده که به تجدید دوباره تعادل ذکر شده کمک ی کند. این حالت به الاستیسیتۀ فیلم گیبس و اثر مارانگونی معروف است و از آن برای توجیه پایداری کف استفاده می شود.
شکل
1-3
ایجاد سطوح جدید
• undefined
• پدیده جذب

معادل انگلیسی اصطلاحات تخصصی این مطلب
2- آنیونی = Anionic آنیونی، دارای بار الکتریکی منفی
5- شویندگی = Detergency پاک کنندگی، دترجنسی
محصول آرایشی که معمولا در انتهای فرایند اصلاح برای تثبیت آرایش مو استفاده می شود
Detergency mechanism = مکانیسم شویندگی
محصول آرایشی که معمولا در انتهای فرایند اصلاح برای تثبیت آرایش مو استفاده می شود
Detergency mechanism = مکانیسم شویندگی
6- آب گریز = Hydrophobe
7- جذب شدن = Take Up جذب شدن
8- غیر قطبی = Non Polar غیر قطبی
9- کشش سطحی = Surface Tension
surface tension of water = کشش سطحی آب
surface tension of water = کشش سطحی آب
surface tension of water
کشش سطحی آب
کشش سطحی آب
10- الکترولیت = Electrolite الکترولیت
11- گروه قطبی = Polar Group گروه قطبی
مطلب فوق را در شبکه های اجتماعی زیر با دوستانتان به اشتراک بگذارید












