سورفکتانت ها: حلالیت شوینده ها
نویسنده:
سید مسیح میرمقتدایی
کارشناس ارشد تحقیق و توسعه شرکت گلتاش
کارشناس ارشد تحقیق و توسعه شرکت گلتاش
massih113@yahoo.com
چکیده: معمولاً حلالیت مولکول های شوینده در آب با افزایش دما افزایش می یابد و معمولاً در دمای خاصی میزان حلالیت به شکل چشمگیری افزایش می یابد که به آن دما نقطه کرافت می گویند. توجه داشته باشیم که برخی شوینده ها از این قانون تبعیت نمی کنند. یعنی با افزایش دما، حلالیتشان کاهش می یابد. کاهش نقطه کرافت باعث افزایش تولید میسل می شود.
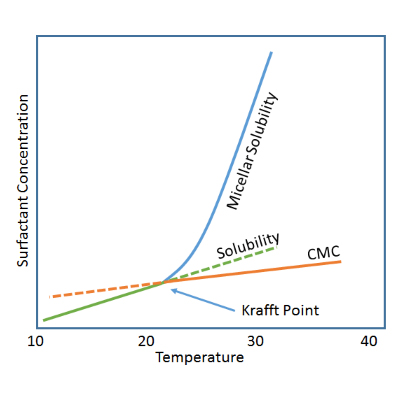
حلالیت مولکول های شوینده در محلول های آبکی با افزایش دما زیادتر می شود (به جز استثنائاتی در مورد برخی از شوینده های غیریونی اتوکسیله شده).
شکل 1-6 اثر تغییرات دما بر روی میزان حلالیت سدیم دودسیل سولفات را نشان می دهد.
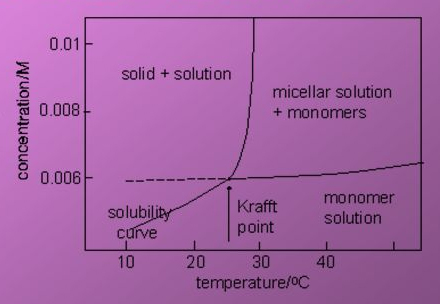
شکل 1-6 نقطه Kraft
در یک دمای خاصی میزان حلالیت به صورت چشم گیری افزایش می یابد که این دما به نقطه Kraft مشهور است. این مورد برای کسانی که به طور عملی با مواد شوینده سر و کار دارند بسیار حائز اهمیت است. زیرا امکان ساخت محلول های غلیظ در بالاتر از این نقطه امکان پذیر می باشد. از این رو اگر این دما کمتر از دمای محیط باشد، بسیار مطلب تر خواهد بود. نقطه Kraft دمایی است که بالاتر از تشکیل میسل ها قرار دارد. حلالیت شوینده های غیریونی بر پایه اتیلن اکسید، با افزایش دما کاهش می یابد. نقطه مذکور برای این دسته از شوینده ها یک نقطه تئوری و در دمایی کمتر از صفر درجه می باشد. شوینده های غیریونی اتوکسیله شده ایی که زنجیره آبگریز بزرگی داشته باشند، دارای نقطه Kraft بالاتر از صفر درجه هستند.
نقطه Kraft و حلالیت شوینده های آنیونی به وسیله یون مخالف (کانتریون)، مشخص می گردد. نمک های سدیمی اسیدهای چرب، دارای نقاط Kraft بالاتری نسبت به انواع پتاسیمی آن ها هستند ولی این حالت برای دودسیل سولفات ها بر عکس است. این نقطه در حالتی که نمک کلسیمی اسید چرب با نک سدیمی مقایسه شود، بسیار بالاتر خواهد بود زیرا تمایل انواع کلسیمی جهت ایجاد میسل کمتر از انواع سدیمی است.
بنابراین آبهای سخت (حاوی یون کلسیم) حلالیت صابون ها را کاهش می دهند. به علارت دیگر نمک های کلسیمی اکثر شوینده ها، حلالیت زیادتری در محلول های هیدروکربنی دارد.
کاهش نقطه Kraft باعث افزایش تولید میسل می شود که این امر با افزایش خصلت آبدوستی و یا کاهش خصلت آبگریزی در ارتباط است.
بنابراین:

شکل 1-6 نقطه Kraft
نقطه Kraft و حلالیت شوینده های آنیونی به وسیله یون مخالف (کانتریون)، مشخص می گردد. نمک های سدیمی اسیدهای چرب، دارای نقاط Kraft بالاتری نسبت به انواع پتاسیمی آن ها هستند ولی این حالت برای دودسیل سولفات ها بر عکس است. این نقطه در حالتی که نمک کلسیمی اسید چرب با نک سدیمی مقایسه شود، بسیار بالاتر خواهد بود زیرا تمایل انواع کلسیمی جهت ایجاد میسل کمتر از انواع سدیمی است.
بنابراین آبهای سخت (حاوی یون کلسیم) حلالیت صابون ها را کاهش می دهند. به علارت دیگر نمک های کلسیمی اکثر شوینده ها، حلالیت زیادتری در محلول های هیدروکربنی دارد.
کاهش نقطه Kraft باعث افزایش تولید میسل می شود که این امر با افزایش خصلت آبدوستی و یا کاهش خصلت آبگریزی در ارتباط است.
بنابراین:
1- وارد کردن گروه های اتوکسی به مولکول دودسیل سولفات، باعث افزایش حلالیت می شود (اما افزایش تعداد گروه های EO باعث کاهش CMC نمی شود).
2- کاهش طول زنجیره هیدروکربنی ممکن است باعث از بین رفتن برخی از خواص دیگر شود.
3- افزایش شاخه های زنجیره آبگریز ممکن است مولکول حاصل را از نظر زیستی غیر قابل تجزیه شدن کند.
4- معمولاً افزایش الکترولیتها باعث افزایش نقطه Kraft می شود.
5- افزودن الکل های سبک باعث کاهش نقطه Kraft می شود.
2- کاهش طول زنجیره هیدروکربنی ممکن است باعث از بین رفتن برخی از خواص دیگر شود.
3- افزایش شاخه های زنجیره آبگریز ممکن است مولکول حاصل را از نظر زیستی غیر قابل تجزیه شدن کند.
4- معمولاً افزایش الکترولیتها باعث افزایش نقطه Kraft می شود.
5- افزودن الکل های سبک باعث کاهش نقطه Kraft می شود.
• undefined
• حلالیت شوینده ها

معادل انگلیسی اصطلاحات تخصصی این مطلب
1- آنیونی = Anionic آنیونی، دارای بار الکتریکی منفی
3- اتوکسیله = Ethoxylated اتوکسیله، ترکیبی به آن مولکول اتیلن اکساید اضافه شده.
4- اسید چرب = Fatty Acid اسید چرب
اسیدهای چرب، مواد سازنده چربی ها و روغن ها
exogenous fatty acids = اسیدهای چرب منابع خارجی
unsaturated fatty acid = اسیدهای چرب غیر اشباع
non-esterified fatty acids, NEFA = اسیدهای چرب استری نشده
coconut fatty acid diethanolamide = کوکونات فتی اسید دی اتانول آمید
Lauric acid, dodecanoic acid, saturated fatty acid with a 12-carbon atom chain = لوریک اسید، دودکانوئیک اسید، اسید چرب اشباع شده با 12 اتم کربن
اسیدهای چرب، مواد سازنده چربی ها و روغن ها
exogenous fatty acids = اسیدهای چرب منابع خارجی
unsaturated fatty acid = اسیدهای چرب غیر اشباع
non-esterified fatty acids, NEFA = اسیدهای چرب استری نشده
coconut fatty acid diethanolamide = کوکونات فتی اسید دی اتانول آمید
Lauric acid, dodecanoic acid, saturated fatty acid with a 12-carbon atom chain = لوریک اسید، دودکانوئیک اسید، اسید چرب اشباع شده با 12 اتم کربن
fatty acids
اسیدهای چرب، مواد سازنده چربی ها و روغن ها
اسیدهای چرب، مواد سازنده چربی ها و روغن ها
5- صابون ها = Soaps صابون ها
Cold cream soaps = صابون های حاوی کلدکرم
antimicrobial soaps = صابون های آنتی میکروبی
Cold cream soaps = صابون های حاوی کلدکرم
antimicrobial soaps = صابون های آنتی میکروبی
antimicrobial soaps
صابون های آنتی میکروبی
صابون های آنتی میکروبی
soaps
صابون ها
صابون ها
6- دمای محیط = Ambient Temperature
7- یون کلسیم = Calcium Ion یون کلسیم
8- الکترولیت = Electrolite الکترولیت
9- اسیدهای چرب = Fatty Acids اسیدهای چرب، مواد سازنده چربی ها و روغن ها
exogenous fatty acids = اسیدهای چرب منابع خارجی
non-esterified fatty acids, NEFA = اسیدهای چرب استری نشده
exogenous fatty acids = اسیدهای چرب منابع خارجی
non-esterified fatty acids, NEFA = اسیدهای چرب استری نشده
fatty acids
اسیدهای چرب، مواد سازنده چربی ها و روغن ها
اسیدهای چرب، مواد سازنده چربی ها و روغن ها
مطلب فوق را در شبکه های اجتماعی زیر با دوستانتان به اشتراک بگذارید












