سورفکتانت ها: امولسیون کنندگی شوینده ها
نویسنده:
سید مسیح میرمقتدایی
کارشناس ارشد تحقیق و توسعه شرکت گلتاش
کارشناس ارشد تحقیق و توسعه شرکت گلتاش
massih113@yahoo.com
چکیده: وقتی یک ماده نامحلول مثل روغن به آب حاوی شوینده اضافه می شود، احتمال تشکیل امولسیون وجود دارد. این امولسیون می تواند روغن در آب یا آب در روغن باشد. دو حالت دیگر هم ممکن است به وجود آید که یکی انحلال روغن در آب و یا تشکیل میکروامولسیون ها است. پارامتر HLB ارتباط منطقی بین ساختار شوینده و امولسیون کنندگی آن را نشان می دهد.
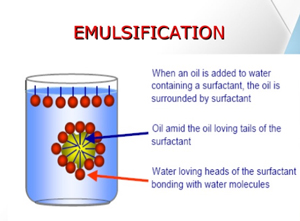
یکی از گسترده ترین موارد استفاده از شوینده ها حل کردن و یا دیسپرس کردن مواد نامحلول در آب (عموماً ترکیبات آلی) در محیط های آبی است.
مواردی مانند رنگ، چسب ها، مواد تکمیل کننده در نساجی، پوشش های کاغذ، مواد تکمیل کننده در ساخت چرم، پاک کننده های دست و غیره که با ترکیبات آلی فرموله شده و قابل انحلال در آب نمی باشند. در سال های اخیر تمایل برای جایگزینی کلی و یا جزئی حلال ها با اب زیادتر شده است. دلیل اصلی این امر افزایش پراکنده شدن حلال های سمی بکار برده می باشد. به علاوه محصولات بر پایه آب به دلیل استفاده و قابلیت تمیز شدنف راحت تر، بیشتر مورد توجه مصرف کنندگان قرار دارند. ولی دلیل اصلی که تولیدکنندگان را بدین سمت سوق می دهد، رزان تر بودن این حلال است. از سوی دیگر نوسان قیمت و موجودی در بازار معاملات نیز جزء معضلات این حلال نمی باشد. تمامی این دلیال باعث شده است تا درخواست های زیادی جهت استفاده از مواد محلول و قابل دیسپرس در آب به وجود آید.
1- یک امولسیون روغن در آب (o/w): این حالت شامل دو فاز مایع است که روغن به صورت گلبول هایی درون یک فاز یکپارچه آبی دیسپرس می شود. ظاهر چنین سیستمی کدر و سفیدرنگ بوده و ناپایدار می باشد به طوری که در اثر ساکن ماندن، دو فاز از هم جدا می شوند. این سیستم ها هدایت الکتریکی بالایی از خود نشان می دهند.
2- یک امولسیون آب در روغن (w/o): این حالت شامل دو فاز مایع است که، آب به صورت گلبول هایی درون یک فاز یکپارچه روغنی دیسپرس می شود. ظاهر چنین سیستم هایی کدر و سفیدرنگ بوده و ناپایدار می باشند به طوری که در اثر ساکن ماندن دو فاز از هم جدا می شوند. این سیستم ها دارای هدایت الکتریکی ضعیفی هستند.
3- انحلال روغن در محلول آب – شوینده: به ظاهر روغن در محلول آبی حل می شود. ظاهر محلول همانند قبل (زمانی که روغن اضافه شد) می باشد. این سیستم ها پایدار بوده و در اثر ساکن ماندن دو فاز نمی شوند. هدایت الکتریکی آن ها نیز بسیار بالا است.
4- تشکیل میکروامولسیون ها: روغن در محلول آبی حل یا دیسپرس می شود. ظاهر آن شفاف یا تقریباً شفاف بوده که اغلب یک محلول رنگی ایجاد می کند (نارنجی متمایل به قرمز یا آبی). چنین سیستم هایی پایدارند و در اثر سکون دو فاز نمی شود. در این فرم امولسیون، هدایت الکتریکی بسیار بالا است.
در عمل این سیستم های متفاوت به وسیله تغییر نوع شوینده، نسبت روغن/آب/شوینده و افزودن ترکیبات غیرشوینده ایجاد می شوند.
در عمل مشخص گردیده است که مخلوطی از شوینده ها با حلالیت متفاوت، امولسیون های بهتری از نظر میزان پایداری ایجاد می کنند. بحث پیرامون میکروامولسیون در بخش 1-8-4 دلیل این امر را بیشتر روشن می کند.
تلاش های بسیاری جهت ایجاد یک ارتباط منطقی بین ساختار شوینده و خصلت امولسیون کنندگی آن ها صورت گرفته است. موفق ترین آن ها که هنوز هم مورد استفاده قرار می گیرد، هیدروفیل-لیپوفیل بالانس (HLB) می باشد که برای اولین بار توسط Griffin (1949) ارائه شد. ثابت شده است که این نظریه برای توجیه خصلت امولسیون کنندگی شوینده های غیریونی بسیار مؤثر بوده ولی برای انواع یونی کاریی آن به خوبی انواع غیریونی نمی باشد.
گریفین پیشنهاد کرد که عدد HLB بر اساس ساختار شیمیایی محاسبه شود که در این نظریه HLB برابر است با درصد گروه های آبدوست (بر حسب مولار) تقسیم بر عدد 5. بنابراین حداکثر مقدار HLB برابر با 20 خواهد بود که بیانگر انحلال پذیری کامل شوینده مربوطه در آب، و HLB صفر نشان دهنده نامحلول بودن کامل آن در آب است.
جهت تقریب زدن عدد HLB می توان مقدار کمی از شوینده را به آب اضافه کرده و آن را تکان داد. بنابراین شوینده های دارای HLB کم برای امولسیون های روغن در آب و شوینده های دارای HLB زیاد برای ایجاد امولسیون های آب در روغن مورد استفاده قرار می گیرند.
عدد HLB
دما اثر بسیار زیادی بر روی سیستم های امولسیونی ساخته شده با شوینده های غیریونی (اتوکسیله شده) دارد. افزایش دما باعث یک تغییر فاز از o/w به w/o می شود که این جابه جایی به دلیل کاهش حلالیت شوینده های غیریونی در آب در اثر افزایش دما می باشد. دمایی که در ان این تغیر فاز اتفاق می افتد به دمای تغیر فاز (PIT) شهرت یافته است.
PIT را می توان به عنوان یک روش برای ساخت امولسیون بکار برد. امولسیونی که در نزدیکی دمای تغییر فاز تولید شودف دارای حداقل اندازه ذرات می باشد. سپس امولسیون حاصل جهت استفاده متداول و یا انبارش سرد می شود.
در یک محلول آبی، سدیم دودسیل بنزن سولفونات (SLABS) تنها مقدار کمی از هپتان را حل می کند ولی اگر SLABS در سدیم کلراید M 1/0 حل شده و به نست مولی 1:8 به آن اکتانول اضافه شود، مخلوط حاصل مقدار محسوسی از هپتان را حل خواهد کرد و یک محلول شفاف تشکیل می شود که این ترکیب یک میکروامولسیون خواهد بود.
SLABS ابتدا به صورت میسل های کروی وجود دارد (شکل 1-11). افزایش نمک بار مؤثر گروه قطبی را تغییر می دهد. همچنین افزوده شدن اکتانول به میسل، آن را از فرم کروی به استوانه ایی تبدیل کرده که در این حالت یک میسل مرکب ایجاد خواهد شد.
این استوانه می تواند حجم زیادتر قابل ملاحظه ایی را نسبت به فرم کروی اشغال کند. اکنون حجم بیشتر میسل استوانه ایی نسبت به میسل کروی می تواند مقادیر زیادتری از هپتان را حل کرده و موجب ایجاد میکروامولسیون شود. دلیل این تغییر کاهش بار سر قطبی مولکول های SLABS بوده که این امر موجب قرار گرفتن نزدیک تر این مولکول ها با ساختاری متفاوت در کنار یکدیگر است.
میزان انباشتگی مولکول ها به اندازه های نسبی گروه های آبگریز و ابدوست بستگی دارد. عامل تأثیرگذار در قسمت آبدوست، اندازه آن می باشد بلکه در صورت یونی بودن، در محلول های شوینده بر روی میزان بار تدثیرگذار است و اگر به صورت زنجیره پلی اتیلن گلیکولی باشد، بر روی میزان حلالیت مؤثر خواهد بود.
اندازه مؤثر قسمت آبگریز به خطی بودن، شاخه دار بودن و یا تعداد زنجیره های آبگریز در یک مولکول بستگی دارد. واضح و مبرهن است که چنین تنوعی در زنجیره آلکیلی می تواند در استفاده عملی از شوینده ها موجب تفاوت هایی شود. حال اگر یک مولکول شوینده را به صورت یک سر (با سطح مقطع ah) و یک دم (با سطح مقطع ac) تجسم کنیم (شکل 1-12)، این مولکول در سطح مابین لایه روغن – آب جذب شده و یک لایه تک مولکولی ایجاد می کند.
یک تابع به نام نسبت تراکم (packing ratio) به صورت زیر قابل تعریف است:
اگر گروه ها داری مقطع عرضی نسبتاً یکسانی باشند P=1 خواهد بود بنابراین مولکول ها به راحتی در کنار یک دیگر قرار گرفته و سطحی صاف ایجاد می کنند (شکل 1-13). اگر مقاطع عرضی در دو گروه متفاوت باشند مثلاً گروه آبدوست بزرگتر از گروه آبگریز باشد P < 1 بوده و بنابراین برای بهترین حالت انباشتگی، سطح به سمت گروه کوچکتر خمیده می شود. این حالت بیشتر تمایل برای ایجاد امولسیون روغن در آب را دارا است. اگر اندازه گروه ها به صورتی باشد که گروه آبدوست کوچکتر از گروه آبگریز باشد، P>1 بوده لذا جهت ایجاد بهترین حالت انباشتگی، سطح به سمت گروه کوچکتر خم می شود که این حالت تمایل بیشتری برای ایجاد امولسیون های آب در روغن دارد.
حالت های مشابه دیگری نیز برای تشکیل میسل وجود دارد. برای ایجاد میسل های کوچک و متراکم در آب، بهترین حالت تراکم، مانند حالت 1-13b خواهد بود که در آن گروه آبدوست بسیار بزرگتر از گروه آبگریز است. جهت ایجاد میسل های بزرگتر با شکل متفاوت و نظم ساختاری کمتر، کاهش اندازه مؤثر گروه آبدوست و شکستن تراکم گروه های آبگریز مورد نیاز می باشد.
افزودن کلرید سدیم سبب می شود تا اندازه گروه آبدوست، کاهش یابد، در حالی که احتمالاً اکتانول به وسیله نفوذ به میان زنجیره های آلکیلی، موجب شکستن حالت متراکم آن ها شده و در ساختار میسل ایجاد شده شرکت می کند. هرچند که ممکن است این نظریه تخریب فرم متراکم اشتباه باشد، ولی نتیجه نهایی به صورتی است که برای ایجاد یک ساختار پایدارف بر روی حالت تراکم نهایی مؤثر می باشد. میسل حاصل می تواند مقادیر قابل توجهی از هپتان را جذب کند، اما نکته مهم تر این است که حذف ممانعت های تراکمی زنجیره ها، می تواند باعث ایجاد یک هسته هپتان مایع شده و میسل های متورم شده به میکروامولسیون تبدیل شوند.
اما چرا این حالت برای SLABS به تنهایی اتفاق نمی افتد؟ زیرا تراکم مولکول ها درون میسل کرویف ساختاری را ایجاد می کند که بسیار پایدارتر از ان است که بتواند گسترش یابد. این حالت تا زمانی که اندازه های نسبی گروه های آبگریز و ابدوست تغییر یابدف مثلاً با افزودن نمک، کماکان پابرجا خواهد بود.
در نسبت های تراکمی (P) کمتر از 3/1، توده های کروی در محلول آبکی شکل می گیرند ولی هنگامی که P بین 3/1 و 2/1 باشد میسل هایی استوانه ایی ایجاد می شوند. در P های بین 2/1 تا 1، میکروامولسیون ها به وجود می آیند. اگر P بزرگتر از 1 باشد امولسیون های آب در روغن تولید می شوند (ایجاد میکروامولسیون ها با P بزرگتر از 1) با افزایش Pبه اعداد بزرگتر از 2، امولسیون های درشت با حلالیت کم شکل می گیرند.
یک پیشگویی حاصل از این ایده این است که میکروامولسیون ها می توانند به راحتی از فرم o/w به w/o تغییر کنند. بنابراین با افزودن الکترولیت، تغییر دما، افزودن شوینده کمکی و افزودن حلال کمکی انتظار می رود تغییرات قابل ملاحظه ایی در خواص شوینده ها رخ دهد و این تنها در صورتی است که P نزدیک به عدد 1 باشد.
بیشتر شوینده های متداولی که جهت تهیه ترکیبات زداینده ها استفاده میشوند، باید دارای P بسیار کمتری نسبت به 1 باشند. زیرا آن ها به راحتی امولسیون های o/w را ایجاد می کنند و نباید مستعد تغییرات شدید به وسیله الکترولیت ها بوده، به راحتی میکروامولسیون ها را تولید کنند و یا حجم زیادی از حلال ها را حل کنند.
شایان ذکر است اگر یک شوینده دارای سایزهای نسبی مناسبی از گروه آبگریز و آبدوست باشد، نیازی به استفاده از کلرید سدیم و اکتانول نخواهد بود. چنین ماده ایی همانند دی ایزواکتیل سوللفوسوکسینات (DIOS) است که دارای دو زنجیره آلکیل بوده و گروه آبدوست کوچکتر از گروه آبگیز است. DIOS در هپتان حل شده، آب را حل کرده و میکروامولسیون های آب در روغن تولید می کند.
شوینده های غیریونی به دلیل داشتن گروه های آبدوست بزرگ، با انواع یونی متفاوتند. بنابر فرضیات بالا، انتظار می رود ان ها میسل های کروی کوچکی ایجاد کنند. ولی با اینکه نسبت به انواع یوین در غلظت های پایین تری میسل ایجاد می کنند، اندازه میسل های آن ها بزرگتر است. اگر فرض کنیم که نظریه های بالا صحیح باشند، پس باید بپذیریم که گروه آبدوست مؤثر، برای گروه پلی اتیلن گلیکول بسیار کوچکتر از گروه یونی است. شواهدی موجود است که احتمال صحیح بودن این مطلب را بیان می کند. با افزایش محتوای گروه EO نسبت تراکم کاهش یافته و نوع غیر یونی بیشتر شبیه به نوع یونی می شود. ولی نباید تنها از این مفهوم تراکم به عنوان تنها عامل تغییر دهنده مقطع عرضی مؤثر استفاده کرد زیرا اندازه طول زنجیره نیز در میزان تراکمل و اندازه میسل ایجاد شده تأثیر خواهد داشت.
این مفهوم نقطه اری شدن را در انواع غیریونی توجیح می کند. افزایش دما اندازۀ مثر سر قطبی را کاهش داده و موجب کاهش حلالیت زنجیره EO می شود. در این حالت P افزایش یافته و موجب ایجاد یک سطح مسطح تر و توده های بزرگتر می شود. همچنین آن ها نامتقارن تر شده و همان طور که انتظار می رود بر روی ویسکوزیته اثر می گذارند. مفاهیم مذکور را می توان برای توجیه ارتباط بین تشکیل میکروامولسیون ها و کشش های سطحی بسیار پایین نیز بسط دارد.
مواردی مانند رنگ، چسب ها، مواد تکمیل کننده در نساجی، پوشش های کاغذ، مواد تکمیل کننده در ساخت چرم، پاک کننده های دست و غیره که با ترکیبات آلی فرموله شده و قابل انحلال در آب نمی باشند. در سال های اخیر تمایل برای جایگزینی کلی و یا جزئی حلال ها با اب زیادتر شده است. دلیل اصلی این امر افزایش پراکنده شدن حلال های سمی بکار برده می باشد. به علاوه محصولات بر پایه آب به دلیل استفاده و قابلیت تمیز شدنف راحت تر، بیشتر مورد توجه مصرف کنندگان قرار دارند. ولی دلیل اصلی که تولیدکنندگان را بدین سمت سوق می دهد، رزان تر بودن این حلال است. از سوی دیگر نوسان قیمت و موجودی در بازار معاملات نیز جزء معضلات این حلال نمی باشد. تمامی این دلیال باعث شده است تا درخواست های زیادی جهت استفاده از مواد محلول و قابل دیسپرس در آب به وجود آید.
حلالیت و امولسیون ها
اگر یک ترکیب نامحلول در آب (مانند روغن های هیدروکربنی) به محلول آبکی شوینده اضافه شود، احتمالات ذیل وجود دارد:1- یک امولسیون روغن در آب (o/w): این حالت شامل دو فاز مایع است که روغن به صورت گلبول هایی درون یک فاز یکپارچه آبی دیسپرس می شود. ظاهر چنین سیستمی کدر و سفیدرنگ بوده و ناپایدار می باشد به طوری که در اثر ساکن ماندن، دو فاز از هم جدا می شوند. این سیستم ها هدایت الکتریکی بالایی از خود نشان می دهند.
2- یک امولسیون آب در روغن (w/o): این حالت شامل دو فاز مایع است که، آب به صورت گلبول هایی درون یک فاز یکپارچه روغنی دیسپرس می شود. ظاهر چنین سیستم هایی کدر و سفیدرنگ بوده و ناپایدار می باشند به طوری که در اثر ساکن ماندن دو فاز از هم جدا می شوند. این سیستم ها دارای هدایت الکتریکی ضعیفی هستند.
3- انحلال روغن در محلول آب – شوینده: به ظاهر روغن در محلول آبی حل می شود. ظاهر محلول همانند قبل (زمانی که روغن اضافه شد) می باشد. این سیستم ها پایدار بوده و در اثر ساکن ماندن دو فاز نمی شوند. هدایت الکتریکی آن ها نیز بسیار بالا است.
4- تشکیل میکروامولسیون ها: روغن در محلول آبی حل یا دیسپرس می شود. ظاهر آن شفاف یا تقریباً شفاف بوده که اغلب یک محلول رنگی ایجاد می کند (نارنجی متمایل به قرمز یا آبی). چنین سیستم هایی پایدارند و در اثر سکون دو فاز نمی شود. در این فرم امولسیون، هدایت الکتریکی بسیار بالا است.
در عمل این سیستم های متفاوت به وسیله تغییر نوع شوینده، نسبت روغن/آب/شوینده و افزودن ترکیبات غیرشوینده ایجاد می شوند.
تشکیل امولسیون های روغن در آب (o/w) و آب در روغن (w/o)
: شوینده ها بسته به نوع ساختارشان بر روی سطح مابین روغن/آب جذب می شوند (شکل 1-10). هنگامی که شوینده حلالیت زیادتری در فاز یکپارچه داشته باشد، جذب خصلت پایدارکنندگی بسیار حائز اهمیت خواهد بود. این بدان معنی است که در امولسیون های آب در روغن، یک شوینده محلول در آب بسیار کارآمد بوده و در صورتی که امولسیون به صورت روغن در آب باشد، شوینده های محلول در روغن جهت ایجاد امولسیون کارایی بالاتری خواهند داشت.در عمل مشخص گردیده است که مخلوطی از شوینده ها با حلالیت متفاوت، امولسیون های بهتری از نظر میزان پایداری ایجاد می کنند. بحث پیرامون میکروامولسیون در بخش 1-8-4 دلیل این امر را بیشتر روشن می کند.
تلاش های بسیاری جهت ایجاد یک ارتباط منطقی بین ساختار شوینده و خصلت امولسیون کنندگی آن ها صورت گرفته است. موفق ترین آن ها که هنوز هم مورد استفاده قرار می گیرد، هیدروفیل-لیپوفیل بالانس (HLB) می باشد که برای اولین بار توسط Griffin (1949) ارائه شد. ثابت شده است که این نظریه برای توجیه خصلت امولسیون کنندگی شوینده های غیریونی بسیار مؤثر بوده ولی برای انواع یونی کاریی آن به خوبی انواع غیریونی نمی باشد.
گریفین پیشنهاد کرد که عدد HLB بر اساس ساختار شیمیایی محاسبه شود که در این نظریه HLB برابر است با درصد گروه های آبدوست (بر حسب مولار) تقسیم بر عدد 5. بنابراین حداکثر مقدار HLB برابر با 20 خواهد بود که بیانگر انحلال پذیری کامل شوینده مربوطه در آب، و HLB صفر نشان دهنده نامحلول بودن کامل آن در آب است.
جهت تقریب زدن عدد HLB می توان مقدار کمی از شوینده را به آب اضافه کرده و آن را تکان داد. بنابراین شوینده های دارای HLB کم برای امولسیون های روغن در آب و شوینده های دارای HLB زیاد برای ایجاد امولسیون های آب در روغن مورد استفاده قرار می گیرند.
عدد HLB
PIT را می توان به عنوان یک روش برای ساخت امولسیون بکار برد. امولسیونی که در نزدیکی دمای تغییر فاز تولید شودف دارای حداقل اندازه ذرات می باشد. سپس امولسیون حاصل جهت استفاده متداول و یا انبارش سرد می شود.
حلالیت:
افزایش حلالیت ترکیبات آلی نامحلول در آب، در محلول آبی یک شوینده، در اثر انحلال ترکیب آلی در میسل رخ می دهد. هرچند که ترکیب مذکور در قسمت داخلی میسل است، سطح خارجی میسل، بستگی به ساختار شیمیایی ماده شوینده و ماده آلی دارد. حضور مولکول های هم چیوند با شوینده ها ضروری است، هر چند که بر اساس مشاهدات حدس زده می شود اثرات حلالیت زیر نقطه CMC، در حضور گونه های شبه میسلی صورت می گیرد. این در حالی است که عموماً عمل حل کردن این ترکیبات در بالاتر از نقطه CMC انجام می شود. مقدار حلالیت هیدروکربن هاا و بقیه ترکیبات آلی نامحلول در آب با افزایش اندازه میسل افزایش می یابد. بنابراین گونه های غیریونی حلایت زیادتری نسبت به گونه های یونی ایجاد می کنند. همچنین افزایش طول زنجیره آبگریز شوینده باعث افزایش میزان قدرت حل کنندگی آن مولکول می شود. به وسیله افزودنی هایی با خصلت قطبیت بیشتر (مانند الکل های زنجیره بلند) ظاهر محلول شفافیت کمتری پیدا می کند. استفاده از افزوددنی هایی که از لحاظ شکل و اندازه مشابه مولکول های شوینده باشد، معنی دارتر خواهد بود (بخش 1-8-4 را ببینید).میکروامولسیون ها:
تشخیص بین امولسیون های ساده و میکروامولسیون ها کار ساده ای است. امولسیون های ساده کلاً ناپایدارند در صورتی که میکروامولسیون ها بی نهایت پایدار هستند. به عبارت دیگر تفاوت بین حل شدن و تشکیل میکروامولسیون به راحتی با یک نگاه ساده قابل تشخیص نیست. در یک دیدگاه جدید میکروامولسیون ها به صورت میسل های متورم شده معرفی شده اند، هرچند که تمامی صاحب نظران با این دیدگاه موافق نبوده و کماکان کشمکش بر سر تفاوت حل شدن و تشکیل میکروامولسیون ها وجود دارد.در یک محلول آبی، سدیم دودسیل بنزن سولفونات (SLABS) تنها مقدار کمی از هپتان را حل می کند ولی اگر SLABS در سدیم کلراید M 1/0 حل شده و به نست مولی 1:8 به آن اکتانول اضافه شود، مخلوط حاصل مقدار محسوسی از هپتان را حل خواهد کرد و یک محلول شفاف تشکیل می شود که این ترکیب یک میکروامولسیون خواهد بود.
SLABS ابتدا به صورت میسل های کروی وجود دارد (شکل 1-11). افزایش نمک بار مؤثر گروه قطبی را تغییر می دهد. همچنین افزوده شدن اکتانول به میسل، آن را از فرم کروی به استوانه ایی تبدیل کرده که در این حالت یک میسل مرکب ایجاد خواهد شد.
این استوانه می تواند حجم زیادتر قابل ملاحظه ایی را نسبت به فرم کروی اشغال کند. اکنون حجم بیشتر میسل استوانه ایی نسبت به میسل کروی می تواند مقادیر زیادتری از هپتان را حل کرده و موجب ایجاد میکروامولسیون شود. دلیل این تغییر کاهش بار سر قطبی مولکول های SLABS بوده که این امر موجب قرار گرفتن نزدیک تر این مولکول ها با ساختاری متفاوت در کنار یکدیگر است.
شکل
1-11
اندازه مؤثر قسمت آبگریز به خطی بودن، شاخه دار بودن و یا تعداد زنجیره های آبگریز در یک مولکول بستگی دارد. واضح و مبرهن است که چنین تنوعی در زنجیره آلکیلی می تواند در استفاده عملی از شوینده ها موجب تفاوت هایی شود. حال اگر یک مولکول شوینده را به صورت یک سر (با سطح مقطع ah) و یک دم (با سطح مقطع ac) تجسم کنیم (شکل 1-12)، این مولکول در سطح مابین لایه روغن – آب جذب شده و یک لایه تک مولکولی ایجاد می کند.
یک تابع به نام نسبت تراکم (packing ratio) به صورت زیر قابل تعریف است:
P = ac/ah
اگر گروه ها داری مقطع عرضی نسبتاً یکسانی باشند P=1 خواهد بود بنابراین مولکول ها به راحتی در کنار یک دیگر قرار گرفته و سطحی صاف ایجاد می کنند (شکل 1-13). اگر مقاطع عرضی در دو گروه متفاوت باشند مثلاً گروه آبدوست بزرگتر از گروه آبگریز باشد P < 1 بوده و بنابراین برای بهترین حالت انباشتگی، سطح به سمت گروه کوچکتر خمیده می شود. این حالت بیشتر تمایل برای ایجاد امولسیون روغن در آب را دارا است. اگر اندازه گروه ها به صورتی باشد که گروه آبدوست کوچکتر از گروه آبگریز باشد، P>1 بوده لذا جهت ایجاد بهترین حالت انباشتگی، سطح به سمت گروه کوچکتر خم می شود که این حالت تمایل بیشتری برای ایجاد امولسیون های آب در روغن دارد.
1-13
افزودن کلرید سدیم سبب می شود تا اندازه گروه آبدوست، کاهش یابد، در حالی که احتمالاً اکتانول به وسیله نفوذ به میان زنجیره های آلکیلی، موجب شکستن حالت متراکم آن ها شده و در ساختار میسل ایجاد شده شرکت می کند. هرچند که ممکن است این نظریه تخریب فرم متراکم اشتباه باشد، ولی نتیجه نهایی به صورتی است که برای ایجاد یک ساختار پایدارف بر روی حالت تراکم نهایی مؤثر می باشد. میسل حاصل می تواند مقادیر قابل توجهی از هپتان را جذب کند، اما نکته مهم تر این است که حذف ممانعت های تراکمی زنجیره ها، می تواند باعث ایجاد یک هسته هپتان مایع شده و میسل های متورم شده به میکروامولسیون تبدیل شوند.
اما چرا این حالت برای SLABS به تنهایی اتفاق نمی افتد؟ زیرا تراکم مولکول ها درون میسل کرویف ساختاری را ایجاد می کند که بسیار پایدارتر از ان است که بتواند گسترش یابد. این حالت تا زمانی که اندازه های نسبی گروه های آبگریز و ابدوست تغییر یابدف مثلاً با افزودن نمک، کماکان پابرجا خواهد بود.
در نسبت های تراکمی (P) کمتر از 3/1، توده های کروی در محلول آبکی شکل می گیرند ولی هنگامی که P بین 3/1 و 2/1 باشد میسل هایی استوانه ایی ایجاد می شوند. در P های بین 2/1 تا 1، میکروامولسیون ها به وجود می آیند. اگر P بزرگتر از 1 باشد امولسیون های آب در روغن تولید می شوند (ایجاد میکروامولسیون ها با P بزرگتر از 1) با افزایش Pبه اعداد بزرگتر از 2، امولسیون های درشت با حلالیت کم شکل می گیرند.
یک پیشگویی حاصل از این ایده این است که میکروامولسیون ها می توانند به راحتی از فرم o/w به w/o تغییر کنند. بنابراین با افزودن الکترولیت، تغییر دما، افزودن شوینده کمکی و افزودن حلال کمکی انتظار می رود تغییرات قابل ملاحظه ایی در خواص شوینده ها رخ دهد و این تنها در صورتی است که P نزدیک به عدد 1 باشد.
بیشتر شوینده های متداولی که جهت تهیه ترکیبات زداینده ها استفاده میشوند، باید دارای P بسیار کمتری نسبت به 1 باشند. زیرا آن ها به راحتی امولسیون های o/w را ایجاد می کنند و نباید مستعد تغییرات شدید به وسیله الکترولیت ها بوده، به راحتی میکروامولسیون ها را تولید کنند و یا حجم زیادی از حلال ها را حل کنند.
شایان ذکر است اگر یک شوینده دارای سایزهای نسبی مناسبی از گروه آبگریز و آبدوست باشد، نیازی به استفاده از کلرید سدیم و اکتانول نخواهد بود. چنین ماده ایی همانند دی ایزواکتیل سوللفوسوکسینات (DIOS) است که دارای دو زنجیره آلکیل بوده و گروه آبدوست کوچکتر از گروه آبگیز است. DIOS در هپتان حل شده، آب را حل کرده و میکروامولسیون های آب در روغن تولید می کند.
شوینده های غیریونی به دلیل داشتن گروه های آبدوست بزرگ، با انواع یونی متفاوتند. بنابر فرضیات بالا، انتظار می رود ان ها میسل های کروی کوچکی ایجاد کنند. ولی با اینکه نسبت به انواع یوین در غلظت های پایین تری میسل ایجاد می کنند، اندازه میسل های آن ها بزرگتر است. اگر فرض کنیم که نظریه های بالا صحیح باشند، پس باید بپذیریم که گروه آبدوست مؤثر، برای گروه پلی اتیلن گلیکول بسیار کوچکتر از گروه یونی است. شواهدی موجود است که احتمال صحیح بودن این مطلب را بیان می کند. با افزایش محتوای گروه EO نسبت تراکم کاهش یافته و نوع غیر یونی بیشتر شبیه به نوع یونی می شود. ولی نباید تنها از این مفهوم تراکم به عنوان تنها عامل تغییر دهنده مقطع عرضی مؤثر استفاده کرد زیرا اندازه طول زنجیره نیز در میزان تراکمل و اندازه میسل ایجاد شده تأثیر خواهد داشت.
این مفهوم نقطه اری شدن را در انواع غیریونی توجیح می کند. افزایش دما اندازۀ مثر سر قطبی را کاهش داده و موجب کاهش حلالیت زنجیره EO می شود. در این حالت P افزایش یافته و موجب ایجاد یک سطح مسطح تر و توده های بزرگتر می شود. همچنین آن ها نامتقارن تر شده و همان طور که انتظار می رود بر روی ویسکوزیته اثر می گذارند. مفاهیم مذکور را می توان برای توجیه ارتباط بین تشکیل میکروامولسیون ها و کشش های سطحی بسیار پایین نیز بسط دارد.
• undefined
• امولسیون کنندگی شوینده ها

معادل انگلیسی اصطلاحات تخصصی این مطلب
1- قطبیت = Polarity قطبیت، تمایل قطبی
3- کارایی = Efficacy اثربخشی، کارآمد بودن
کارایی
caffeine-like efficacy = اثر شبه کافئینی
کارایی
caffeine-like efficacy = اثر شبه کافئینی
efficacy
اثربخشی، کارآمد بودن
اثربخشی، کارآمد بودن
efficacy2
کارایی
کارایی
4- ممانعت = Inhibit ممانعت
elastase inhibitor = مهارکننده الاستاز
inhibitory potential = توان ممانعت
competitive inhibitor = مهارکننده رقابتی
inhibit 5-alpha reductase = آنزیم پنج آلفا ردوکتاز را مهار می کند
inhibition of 5α-reductase = مهار آنزیم 5 آلفا ردوکتاز
inhibitor of lipid accumulation = مهارکننده انباشت لیپید
MIC, Minimum Inhibitory Concentration = غلظت بازداری حداقل
elastase inhibitor = مهارکننده الاستاز
inhibitory potential = توان ممانعت
competitive inhibitor = مهارکننده رقابتی
inhibit 5-alpha reductase = آنزیم پنج آلفا ردوکتاز را مهار می کند
inhibition of 5α-reductase = مهار آنزیم 5 آلفا ردوکتاز
inhibitor of lipid accumulation = مهارکننده انباشت لیپید
MIC, Minimum Inhibitory Concentration = غلظت بازداری حداقل
6- انبارش = Storage انبارش، نگهداری در انباز، ذخیره کردن
storage, shipment and retuns of products = انبارش، حمل و نقل و بازگرداندن محصولات
storage, shipment and retuns of products = انبارش، حمل و نقل و بازگرداندن محصولات
storage, shipment and retuns of products
انبارش، حمل و نقل و بازگرداندن محصولات
انبارش، حمل و نقل و بازگرداندن محصولات
7- شفافیت = Transparency شفافیت
8- ویسکوز = Viscose ویسکوز، با قوام
9- انباشت = Buildup تجمع انباشتگی
Dead cell buildup = انباشته شدن سلول های مرده
Buildup of dead cells = تجمع یا انباشته شدن سلول های مرده
Pores may be clogged from dead skin cell buildup in the hair follicle = منافذ پوست ممکن است در اثر انباشت سلول مرده در فولیکول مو مسدود شده باشد
Exfoliants are products that help exfoliate the skin and remove excess cell buildup from the skin surface = لایه بردارها محصولاتی هستند که به جداشدن سلولهای مرده پوست کمک می کنند وانباشت بیش از حد سلول روی سطح پوست را می زدایند
Dead cell buildup = انباشته شدن سلول های مرده
Buildup of dead cells = تجمع یا انباشته شدن سلول های مرده
Pores may be clogged from dead skin cell buildup in the hair follicle = منافذ پوست ممکن است در اثر انباشت سلول مرده در فولیکول مو مسدود شده باشد
Exfoliants are products that help exfoliate the skin and remove excess cell buildup from the skin surface = لایه بردارها محصولاتی هستند که به جداشدن سلولهای مرده پوست کمک می کنند وانباشت بیش از حد سلول روی سطح پوست را می زدایند
Exfoliants are products that help exfoliate the skin and remove excess cell buildup from the skin surface
لایه بردارها محصولاتی هستند که به جداشدن سلولهای مرده پوست کمک می کنند وانباشت بیش از حد سلول روی سطح پوست را می زدایند
لایه بردارها محصولاتی هستند که به جداشدن سلولهای مرده پوست کمک می کنند وانباشت بیش از حد سلول روی سطح پوست را می زدایند
Pores may be clogged from dead skin cell buildup in the hair follicle
منافذ پوست ممکن است در اثر انباشت سلول مرده در فولیکول مو مسدود شده باشد
منافذ پوست ممکن است در اثر انباشت سلول مرده در فولیکول مو مسدود شده باشد
buildup
تجمع انباشتگی
تجمع انباشتگی
10- افزودنی = Additive ماده افزودنی، ماده ای که به محصول اضافه می شود.
مثلاً زین کلیر از تکنولوژی انقلابی index match استفاده می کند.
مثلاً زین کلیر از تکنولوژی انقلابی index match استفاده می کند.
11- سر قطبی = Polar Head سر قطبی
12- حلال ها = Solvents حلال ها
residual solvents = حلال باقیمانده
EXTRACTION, Extraction with volatile solvents is the most effective and commonly used method to obtain essences. = استخراج: استخراج با حلال های فرّار موثرترین و رایج ترین روش به دست آوردن گیاهان است.
EXTRACTS, Concentrated perfume or flower products obtained through the process of extraction using volatile solvents. = عصاره: محصولات حاصل از استخراج با حلالهای فرّار كه تغلیظ شده است.
residual solvents = حلال باقیمانده
EXTRACTION, Extraction with volatile solvents is the most effective and commonly used method to obtain essences. = استخراج: استخراج با حلال های فرّار موثرترین و رایج ترین روش به دست آوردن گیاهان است.
EXTRACTS, Concentrated perfume or flower products obtained through the process of extraction using volatile solvents. = عصاره: محصولات حاصل از استخراج با حلالهای فرّار كه تغلیظ شده است.
solvents
حلال ها
حلال ها
13- گونه ها = Species گونه ها، در میکروبیولوژی: مجموعهای از سویهها که در بسیاری از صفات مشترک با هم باشند. در جانورشناسی: گروهی از موجودات شبیه به هم که می توانند تولید مثل کنند و فرزند قابل بارور شدن داشته باشند. مثل اسب یک گونه جانوری است. الاغ یک گونه جانوری است. اسب و الاغ می توانند با هم جفت گیری کنند ولی چون فرزندشان که قاطر است قابل بارور شدن نیست، اسب و الاغ از دو گونه متفاوت هستند.
Lilium species = گونه های لیلیوم
Malassezia species = گونه های قارچ مالاسزیا
predominant species = گونه های غالب
Almond, Prunus species = بادام
reactive oxygen species = گونه های فعال اکسیژن
White willow, Salix species = بید سفید، گونه های بید
reactive oxygen species, ROS = گونه های فعال اکسیژن
limiting the harvest of vegetable species = نیاز به کاشت و برداشت بیش از حد گونه های گیاهی را کاهش می دهد.
oakmoss, Evernia prunastri, a species of lichen = خزه بلوط، گلسنگ
tonka beans, Dipteryx odorata, a species of flowering tree in the pea family = تونکا بین، درخت تانکا، تونکا، گونه ای از یک درخت گلدار از خانواده حبوبات که در عطرسازی استفاده می شود
lilac, common lilac, Syringa vulgaris is a species of flowering plant in the olive family = یاس بنفش یاس شیروانی
ROS, Reactive oxygen species (ROS) are chemically reactive chemical species containing oxygen. Examples include peroxides, superoxide = گونه های فعال اكسیژن
reactive oxygen species, ROS, chemically reactive chemical species containing oxygen. Examples include peroxides, superoxide, hydroxyl radical, and singlet oxygen. = گونه های فعال اکسیژن به اختصار ROS مواد شیمیایی فعال که حاوی اکسیژن می باشند. مثل پروکسیدها، سوپراکسیدها، رادیکال هیدروکسیل و اکسیژن منفرد
Lilium species = گونه های لیلیوم
Malassezia species = گونه های قارچ مالاسزیا
predominant species = گونه های غالب
Almond, Prunus species = بادام
reactive oxygen species = گونه های فعال اکسیژن
White willow, Salix species = بید سفید، گونه های بید
reactive oxygen species, ROS = گونه های فعال اکسیژن
limiting the harvest of vegetable species = نیاز به کاشت و برداشت بیش از حد گونه های گیاهی را کاهش می دهد.
oakmoss, Evernia prunastri, a species of lichen = خزه بلوط، گلسنگ
tonka beans, Dipteryx odorata, a species of flowering tree in the pea family = تونکا بین، درخت تانکا، تونکا، گونه ای از یک درخت گلدار از خانواده حبوبات که در عطرسازی استفاده می شود
lilac, common lilac, Syringa vulgaris is a species of flowering plant in the olive family = یاس بنفش یاس شیروانی
ROS, Reactive oxygen species (ROS) are chemically reactive chemical species containing oxygen. Examples include peroxides, superoxide = گونه های فعال اكسیژن
reactive oxygen species, ROS, chemically reactive chemical species containing oxygen. Examples include peroxides, superoxide, hydroxyl radical, and singlet oxygen. = گونه های فعال اکسیژن به اختصار ROS مواد شیمیایی فعال که حاوی اکسیژن می باشند. مثل پروکسیدها، سوپراکسیدها، رادیکال هیدروکسیل و اکسیژن منفرد
reactive oxygen species
گونه های فعال اکسیژن
گونه های فعال اکسیژن
species
گونه ها، در میکروبیولوژی: مجموعهای از سویهها که در بسیاری از صفات مشترک با هم باشند. در جانورشناسی: گروهی از موجودات شبیه به هم که می توانند تولید مثل کنند و فرزند قابل بارور شدن داشته باشند. مثل اسب یک گونه جانوری است. الاغ یک گونه جانوری است. اسب و الاغ می توانند با هم جفت گیری کنند ولی چون فرزندشان که قاطر است قابل بارور شدن نیست، اسب و الاغ از دو گونه متفاوت هستند.
گونه ها، در میکروبیولوژی: مجموعهای از سویهها که در بسیاری از صفات مشترک با هم باشند. در جانورشناسی: گروهی از موجودات شبیه به هم که می توانند تولید مثل کنند و فرزند قابل بارور شدن داشته باشند. مثل اسب یک گونه جانوری است. الاغ یک گونه جانوری است. اسب و الاغ می توانند با هم جفت گیری کنند ولی چون فرزندشان که قاطر است قابل بارور شدن نیست، اسب و الاغ از دو گونه متفاوت هستند.
14- اتوکسیله = Ethoxylated اتوکسیله، ترکیبی به آن مولکول اتیلن اکساید اضافه شده.
15- غیر یونی = None Ionic غیر یونی
16- ناپایدار = Unstable ناپایدار
Un-scented, unstable, unsaturated = فاقدمواد معطر، ناپایدار، غیر اشباغ
Un-scented, unstable, unsaturated = فاقدمواد معطر، ناپایدار، غیر اشباغ
17- الکترولیت = Electrolite الکترولیت
18- گروه قطبی = Polar Group گروه قطبی
19- پلی اتیلن = Polyethyene
20- ویسکوزیته = Viscosity ویسکوزیته، گرانروی، قوام، مقاومت در برابر جاری شدن
high viscosity at rest = ویسکوزیته بالا در حالت سکون
low-viscosity topical preparation = محصول موضعی با ویسکوزیته پایین
high viscosity at rest = ویسکوزیته بالا در حالت سکون
low-viscosity topical preparation = محصول موضعی با ویسکوزیته پایین
مطلب فوق را در شبکه های اجتماعی زیر با دوستانتان به اشتراک بگذارید












